Modello molecolare della struttura della cobalamina risolta da Dorothy Hodgkin.
Questa intricata ma elegante molecola dal nome esotico di cobalamina, ha una storia interessante che merita di essere raccontata.
La sua vicenda inizia nel lontano 1822 quando il medico scozzese James Scarth Combe per la prima volta descrive i sintomi di una malattia in un lavoro dal titolo “History of a Case of Anaemia”. Qualche anno dopo nel 1855 un altro medico inglese, Thomas Addison del Guy’s Hospital di Londra, pubblica un lavoro dal titolo: “On the Constitutional and Local Effects of Disease of the Supra-renal Capsules”, in cui descrive una malattia simile ed alla quale dà il nome di anemia idiopatica ad indicare che non ne conosce la causa. Comunque, in questo testo Addison descrive undici casi di decessi dovuti a questa patologia caratterizzata da una serie di sintomi quali: pallore, assenza di forze e prostrazione, lingua liscia color magenta. Inoltre, certi malati lamentano formicolio alle dita, disturbi gastrointestinali e neuromuscolari con movimenti scoordinati e andatura incerta.
Più avanti si scoprirà che a questa patologia si associa anche un calo di globuli rossi circolanti che risultano più grandi rispetto alla norma, formazione degli stessi globuli disordinata a livello del midollo osseo, atrofia dello stomaco e ipo-acidità del succo gastrico. La malattia viene definita, in onore del suo scopritore, anemia di Addison o perniciosa in quanto i pazienti di solito muoiono entro 3 anni dall’esordio dei sintomi.
Dovranno passare altri 70 anni prima che nel 1926 tre scienziati americani G.H. Whipple, G.R. Minot e W.P. Murphy trovino una cura. I tre medici osservano che, nutrendo i malati con fegato di bue crudo, questi mostrano in pochi giorni un netto miglioramento clinico e un aumento di globuli rossi. In 2-4 mesi l’anemia si risolve in 45 pazienti e così gli eventuali disturbi neurologici. Per questi risultati i tre scienziati otterranno il Nobel per la medicina nel 1934.
Ma perché i malati guarivano e quale era il fattore responsabile?
La spiegazione arriva solo nel 1948 quando il gruppo di K. Folkers un brillante biochimico delle industrie farmaceutiche Merck & Co. riesce ad isolare e cristallizzare dal fegato di animali una particolare molecola dal colore rosso, idrosolubile in acqua e sensibile alla luce ed al calore, il fattore in grado di curare la malattia. Folkers riceverà in riconoscimento dei suoi contributi scientifici la Medaglia Perkin nel 1960, la Medaglia Priestley nel 1986 e La Medaglia Nazionale della Scienza nel 1990.
Quasi simultaneamente nel 1949, il gruppo coordinato dal chimico inglese E. Lester Smith delle industrie Glaxo riesce ad isolare la stessa molecola sia dal fegato di animali che dalla fermentazione della soia in presenza di un particolare batterio (Streptomyces Griseus). Smith invia i cristalli della nuova molecola alla biochimica Hodgkin dell’Università di Oxford, una pioniera negli studi di cristallografia che aveva già scoperto la struttura della penicillina.
Qualche anno dopo, nel 1955 A. Todd (premio Nobel per la chimica 1957) chiarisce parte della struttura della molecola mentre il biochimico americano H. Barker (medaglia Nazionale della Scienza nel 1969) ne determina alcune forme biologicamente attive nei processi biochimici. Ma, saranno invece proprio la Hodgkin ed il suo gruppo nel 1956 a svelarne la completa conformazione tridimensionale attraverso la diffrazione a raggi x.
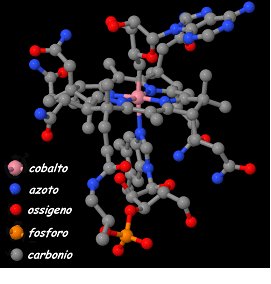
Fig. 1 – La Hodgkin illustra il modello 3D della cobalamina (1963).
Ed ecco come si rappresenta la cobalamina nella sua formula di struttura:
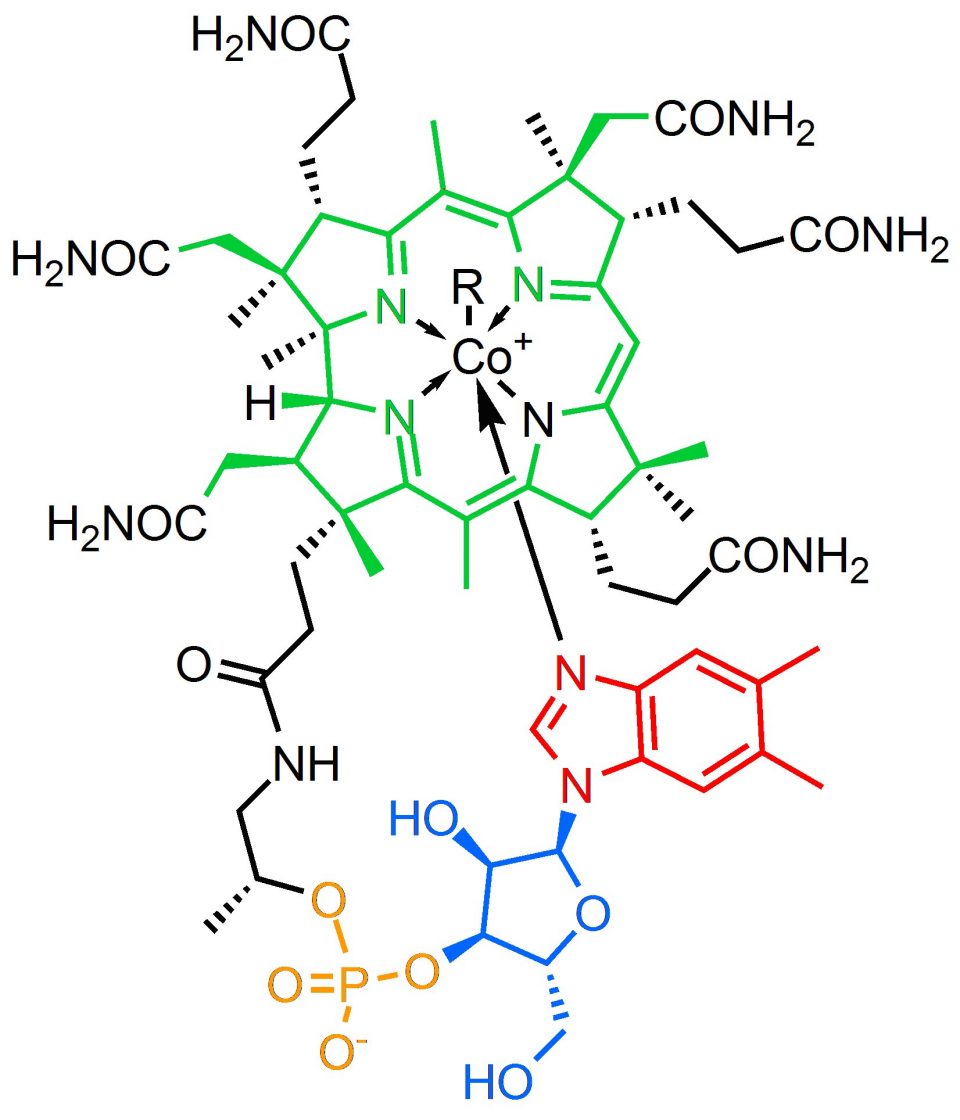
Fig. 2 – Formula di struttura della Cobalamina: anello corrinico (verde), base azotata (rosso), D-ribosio (blu), gruppo fosfato (giallo).
In particolare, la Hodgkin ed il suo gruppo scoprono che la molecola contiene un atomo di Cobalto (Co) all’interno di una complicata geometria ed individua due forme della stessa molecola (la cianocobalamina e l’adenosylcobalamina).
Jenny P. Glusker, successivamente professoressa presso il Fox Chase Cancer Center e all’epoca dottoranda nei laboratori della Hodgkin, ricordava l’enorme quantità di spettri di diffrazione che venivano raccolti ed analizzati uno ad uno allo scopo di determinare le posizioni degli atomi nella struttura. La Glusker dirà in seguito:
“Ciascuna mappatura della densità elettronica necessitava un tempo di elaborazione e calcolo pari a sei settimane di tempo, giorno e notte, utilizzando una stanza piena di computer a schede perforate. Il gruppo realizzò un modello 3D con legami di filo di ferro e atomi di palline di cera che spesso si scioglievano durante le estati calde.”
La fortuna però aiuta la Hodgkin quando casualmente incontra lo scienziato americano, Kenneth N. Trueblood dell’UCLA in visita estiva ad Oxford. Trueblood, dopo aver visitato i laboratori, si offre gratuitamente di contribuire ad effettuare i calcoli necessari alla comprensione della struttura utilizzando il suo super computer in California. La cristallografia a raggi x era stata totalmente rivoluzionata dall’impiego dei computer che consentivano attraverso programmi specifici il calcolo di angoli e lunghezze dei legami presenti e fortunatamente Trueblood disponeva della Ferrari dei computer del tempo.
La struttura completa della molecola pubblicata nel 1956, era sorprendente e complessa. Nel 1961 la Hodgkin insieme a P. Galen Lenhert pubblicò anche la struttura di una forma coenzimatica della stessa molecola. Era la prima volta che i biochimici vedevano un legame carbonio-cobalto e questi studi apriranno la strada alla comprensione dell’interazione tra chimica inorganica e biologica.
Il lavoro della Hodgkin sulla comprensione della struttura della molecola verrà considerato talmente importante che lo stesso L. Bragg (premio Nobel per la fisica 1915) pioniere della tecnica utilizzata dalla Hodgkin lo definirà significativo come “infrangere il muro del suono”. La Hodgkin riceverà per questo lavoro il premio Nobel per la chimica del 1964, terza donna al mondo.
La cobalamina e i suoi derivati si dimostrarono essere attivi in molti processi biochimici la cui comprensione rimanda ai lavori di numerosi scienziati quali Guest, Brennan, Dixon, Mancia, Stupperich, Zelder, Harms, Reitzer, Shibata, etc.
Questa grossa molecola, dalla formula bruta e brutta a capirsi C63H88CoN14O14P, è costituita da diverse parti che per semplificare nella Fig. 1 abbiamo colorato diversamente ed ora spieghiamo brevemente.
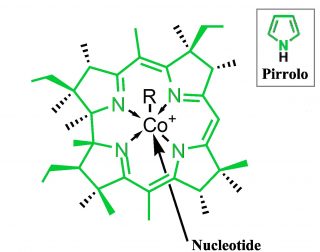
La prima parte, in verde nella Fig. 1, è un macrociclo anche detto struttura corrinica in cui tutti gli spigoli sono atomi di carbonio, questa:
Fig. 3 – Formula di struttura dell’anello corrinico.
Si tratta di un anello formato da quattro molecole di pirrolo legate da ponti metinici (-C=): Al centro del grosso anello abbiamo un atomo di cobalto (Co) legato (coordinato) a 4 atomi di azoto (N). L’atomo di cobalto è coordinato anche perpendicolarmente al piano dell’anello con un nucleotide e con un gruppo cosiddetto funzionale R che può essere di diverso tipo e da cui dipende il nome della molecola. Così se R=-CN avremo la cianocobalamina, R=-OH la idrossicobalamina, R= -CH3 la metilcobalamina, etc.
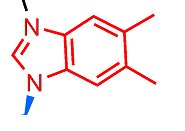
Il nucleotide è costituito da tre gruppi legati tra loro. Una base azotata (5,6 dimetilbenzimidazolo), questa:
Fig. 4 – Formula di struttura della base azotata.
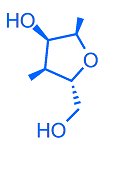
Uno zucchero a cinque atomi di carbonio (zucchero pentoso) che, a complicare la vita, è anche chirale (CS2015) il D-ribosio, questo:
Fig. 5 – Formula di struttura del D-Ribosio.
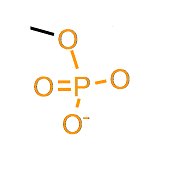
Ed un gruppo fosfato, questo:
Fig. 6 – Formula di struttura del gruppo fosfato.
Assemblando i vari pezzi la rappresentazione spaziale, in cui non sono raffigurati gli atomi di idrogeno, è approssimativamente questa:
Fig. 7 – Formula di struttura 3D della cobalamina.
Una piccola ma curiosa digressione. L’atomo di cobalto della cobalamina si lega fortemente e facilmente al gruppo cosiddetto cianuro (CN–). Per questo motivo la somministrazione di Cobalamina nella forma di idrossido è un metodo sicuro e facile nei casi di sospetta intossicazione da cianuri.
Ma la storia non finisce qui perché insieme ai tentativi di studiare e comprendere la complessità funzionale della molecola da un punto di vista dei processi biochimici, si aggiunse quello di effettuarne anche la sintesi chimica.
Partendo dai risultati della Hodgkin, questo traguardo venne raggiunto da Robert Burns Woodward chimico americano dell’Università di Harward (Nobel per la chimica 1965) e Albert Eschenmoser chimico svizzero dell’ETH nel 1972 dopo 11 anni di lavoro. Questa sintesi (vi invitiamo a cliccare sul link solo per constatare il numero di passaggi successivi necessari) è considerata un esempio classico nel campo della chimica dei prodotti naturali. I primi tentativi iniziano nel 1960 presso l’ETH e nel 1961 ad Harward mentre la collaborazione stretta tra i due gruppi inizia nel 1965.
Il lavoro richiese gli sforzi di 91 ricercatori post doc (scienziati che hanno conseguito il titolo di PhD) principalmente di Harward e di 12 studenti PhD provenienti da 19 diverse nazioni.
La complessità del lavoro era legato al fatto che si trattava di operare un ottantina di reazioni di sintesi successive i cui prodotti dovevano essere verificati attraverso analisi chimiche complesse. In aggiunta, poiché molte molecole possedevano centri chirali, le sintesi dovevano essere stereo selettive o necessitare della separazione dei diversi enantiomeri prodotti (CS2015).
A questo punto può accadere che un chimico o un biochimico, di fronte ad una sintesi di questa portata, ragionando sulla possibilità che ciò sia avvenuto in modo spontaneo, assuma un atteggiamento rispettoso nei confronti della natura, smetta di citare a vanvera brodi primordiali, reazioni casuali, tempi geologici, condizioni irripetibili e quant’altro sulla formazione di macro molecole organiche e si limiti ad ammettere socraticamente di “sapere di non sapere”. Quando ciò avviene è un chiaro sintomo di guarigione imminente da una forma di patologia perniciosa e diffusa, lo scientismo.
Fig. 8 – Robert Burns Woodward; alle spalle l’anello corrinico.
Ma andiamo avanti con la nostra storia. Il lavoro di sintesi chimica di Woodward & Co. procedette di pari passo con la comprensione della sintesi biochimica della molecola. Successivo ma fondamentale fu il contributo di F. Blanche e del suo gruppo presso la Rhône-Poulenc sul batterio aerobico Pseudomonas denitrificans. Blanche si avvalse dell’intuizione e dell’esperienza del chimico inglese Alan Battersby (Medaglia Reale 1984 e Medaglia Copley 2000) dell’Università di Cambridge e del chimico scozzese A. Scott (Premio Nakanishi 2003 ed altre innumerevoli onorificenze scientifiche). Da queste ricerche, oltre la comprensione sulla sintesi in ambiente aerobico, fu evidente che doveva esistere una biosintesi alternativa “anaerobica” della cobalamina.
Gli studi successivi permisero di comprendere che la biosintesi della cobalamina avveniva in diversi batteri e che, a causa della natura chimica complessa della molecola, più di 30 geni erano necessari per l’intera biosintesi ex novo (pari a circa 1% di un genoma batterico tipico). Si capì inoltre che, come era stato ipotizzato, esistevano in natura due diverse vie biosintetiche per la cobalamina: (1) una via aerobica, o più precisamente una sintesi ossigeno dipendente che si trovava in organismi come il sopracitato Pseudomonas e (2) una via anaerobica o sintesi ossigeno-indipendente studiata in organismi come il Bacillus, megaterium, P. shermanii e Salmonella typhimurium.
In questo caso, la natura si è dimostrata molto più brava dell’uomo. Il processo di sintesi biochimica, altrettanto complesso ma più efficiente e meno costoso di quello chimico, è quello attualmente in uso per la produzione industriale di questo composto. Pertanto oggi la cobalamina è esclusivamente prodotta attraverso processi di fermentazione biosintetica utilizzando batteri selezionati e geneticamente ottimizzati. Fra le specie di batteri in grado di produrre la cobalamina abbiamo: Aerobacter, Agrobacterium, Alcaligenes, Azotobacter, Bacillus, Clostridium, Corynebacterium, Flavobacterium, Micromonospora, Mycobacterium, Norcardia, Propionibacterium, Protaminobacter, Proteus, Pseudomonas, Rhizobium, Salmonella, Serratia, Streptomyces, Streptococcus and Xanthomonas.
L’applicazione dell’ingegneria genetica (mutagenesi indiretta e manipolazione genetica diretta) accoppiata alla dettagliata comprensione della biosintesi della cobalamina hanno permesso ad aziende come la francese Rhône-Poulenc di incrementare la produzione per via batterica fino a coprire oltre l’80% della produzione mondiale di questo composto.
Torniamo adesso alla nostra storia. Dopo aver compreso che il fegato crudo e più in generale la carne si rivelano una fonte molto ricca di cobalamina che costituisce il fattore cosiddetto estrinseco, qualche tempo dopo, un altro scienziato W. Castle ipotizzò che vi fosse un rapporto tra la presenza massiccia della cobalamina (efficacia curativa del fegato crudo) e la bassa acidità dello stomaco dei pazienti indicata da Addison.
Castle pensò che nel succo gastrico di una persona sana (ad elevata acidità) fosse presente un fattore necessario all’assorbimento della nostra cobalamina contenuta nelle carni. Si racconta che, per verificarlo il ricercatore si fosse mangiato un grosso hamburger, avesse prelevato aspirandolo il proprio succo gastrico e lo avesse trasferito con una sonda in un malato di anemia. Comunque siano andate le cose, in pochi giorni, Castle registrò nel paziente un aumento di globuli rossi: questa era la conferma che nello stomaco dei soggetti normali era presente un fattore (“intrinseco”) (Fig. 9) necessario per l’assorbimento della cobalamina (fattore “estrinseco”).
 Fig. 9 – Struttura del complesso Cobalamina-Fattore Intrinseco a 2.6 Å.
Fig. 9 – Struttura del complesso Cobalamina-Fattore Intrinseco a 2.6 Å.
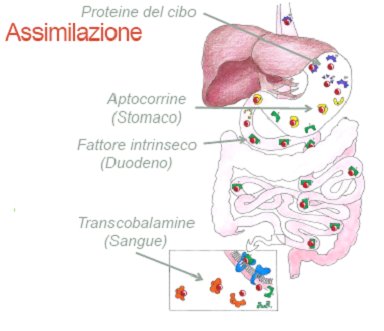
Cerchiamo ora di ricapitolare l’intero ciclo di assimilazione di questa molecola (Fig. 10).
1) La cobalamina assunta attraverso le proteine del cibo in cui è presente, viene liberata nello stomaco per opera dell’acidità gastrica (e dell’enzima pepsina). Qui si lega a particolari glicoproteine salivari dette anche cobalofiline o aptocorrine.
2) Successivamente, nel pancreas la cobalamina si distacca dalle cobalofiline per opera del succo pancreatico e successivamente nell’intestino tenue si lega al fattore intrinseco che viene prodotto dalle “cellule parietali” del fondo e del corpo dello stomaco.
3) A questo punto, il complesso cobalamina-fattore intrinseco si comporta come una sorta di cavallo di Troia che può entrare nel citoplasma delle cellule dove si stacca nuovamente e si lega ad una proteina che, con molta fantasia, è stata chiamata transcobalamina II (TCII) e che funge da trasportatore della cobalamina nel sangue attraverso il quale viene assimilata nel corpo.
Fig. 10 – Assimilazione della cobalamina.
Senza entrare troppo nello specifico questa molecola è fondamentale per un mucchio di cose importanti; nella sintesi degli acidi nucleici (DNA) ovvero nella crescita dei tessuti, nella normale formazione dei globuli rossi, nel metabolismo energetico, nel funzionamento del sistema immunitario, nella divisione cellulare, etc.
“Ebbene?” Direte voi. “Che c’e’ di così interessante in uno dei tanti processi biochimici che avvengono nel nostro corpo?”
Il fatto interessante è che la nostra complessa molecola oggi più nota con il nome di Vitamina B12, il nostro organismo non è in grado di produrla. Gli animali tra cui l’uomo ed i protisti necessitano della cobalamina ma non sono in grado di sintetizzarla. Le piante e i funghi non la utilizzano ne la sintetizzano. In natura la sintesi della vitamina B12 avviene solo per opera dei microrganismi sopra citati (batteri ed archea) che attecchiscono sulla superficie delle piante (microflora ruminale).
Si trova immagazzinata soltanto in prodotti di origine animale (carne, pesce, latticini, uova, molluschi) che la contengono in quantità adeguate. Pertanto, gli animali ruminanti la assimilano pascolando all’aperto, le loro carni ne sono particolarmente ricche e si concentra in quantità maggiore nel fegato.
I carnivori la assimilano mangiando la carne degli erbivori. La cosa curiosa è che gli erbivori che vengono allevati con mangimi sterilizzati ne sono privi e bisogna fornirgliela e anche le persone con dieta strettamente vegana (CS2013) devono compensare per via artificiale la carenza o inserendo nella dieta cereali fortificati. Insomma, non esistono piante o vegetali commestibili dai quali attingere in forma attiva la vitamina B12.
Vi chiederete ora come fanno certi batteri ad effettuare per via biochimica una sintesi così complessa da avere richiesto per la sua comprensione e realizzazione 200 anni, sei premi nobel, centinaia di ricercatori tra le migliori menti oltreché molte risorse tecnico scientifiche ed economiche?
A spiegarlo ci hanno provato in molti (Jahn, Hodgson, Ponnamperuma, Raux, Eschenmoser, Roth, Ishida, Benner, etc) ma le tessere assemblate di questo grosso puzzle (singoli passi di una sintesi biochimica complessa) sono solo sufficienti ad esprimere una conclusione ipotetica e astratta secondo cui la nostra cobalamina sarebbe comparsa in un primitivo RNA di alcuni batteri, selezionata a causa della sua abilità a garantire la fermentazione di piccole molecole attraverso cui questi batteri sarebbero stati in grado di produrre l’energia necessaria alla loro sopravvivenza.
Questa ipotesi scientifica alla luce di quanto abbiamo evidenziato è molto debole ed al momento non può neanche essere dimostrata poiché come ebbe a dire G. Natta, premio Nobel per la Chimica 1963;
“Il tempo a disposizione perché certi processi avvenissero nel senso desiderato è assolutamente sproporzionato rispetto ai tempi dei nostri normali esperimenti”
Per il momento l’unica cosa certa in questa storia è che la complessità della materia vivente è tale già a partire dai suoi mattoni fondamentali. Anche soltanto limitandoci ai primitivi batteri si rimane stupiti nel vedere la loro funzionalità biochimica e storditi nel cercare di comprendere in che modo abbiano potuto realizzare determinanti processi basati su molecole così complesse da sintetizzare come ad esempio la nostra cobalamina.
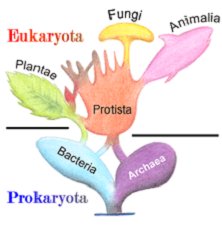
Una seconda questione che non si riesce a capire è: perché la biosintesi di questa molecola essenziale per tutti gli animali sia legata e sorprendentemente limitata solo ad alcune specie di batteri procarioti i quali apparentemente non hanno avuto nulla a che fare con la transizione procarioti-eucarioti?
Fig. 11 – Ipotetico albero evolutivo procarioti/eucarioti.
Infatti, la teoria più accreditata sull’origine degli organismi eucarioti ipotizza la fusione biologica tra almeno due organismi procarioti: un archaea ed un batterio (Fig. 11). Ma se nessun eucariota (pianta, animale, etc) è in grado di produrre da solo la cobalamina allora dobbiamo pensare che questa fusione non coinvolse procarioti in grado di sintetizzarla.
Ma allora la terza domanda che si pone è: perché ne abbiamo avuto bisogno nei processi biochimici successivi se originariamente non la utilizzavamo né la producevamo?
Anche qui non abbiamo risposte ma solo ipotesi. La fotosintesi e la respirazione avrebbero permesso lo sviluppo di piante ed animali che non producevano cobalamina e non la utilizzavano. In seguito gli animali avrebbero sviluppato reazioni dipendenti da questa molecola a causa dei vantaggi biochimici offerti dal suo utilizzo. Il condizionale è d’obbligo trattandosi solo di passaggi astratti.
Ma, se così fosse, perché non esistono allora animali che non la utilizzano ovvero organismi eucarioti che non hanno seguito questo percorso?
Neanche a questa evidenza sappiamo attualmente rispondere. Ma. anche se non siamo riusciti a rispondere in modo esaustivo ai diversi quesiti, tuttavia, le domande rimangono affascinanti ed attendono risposte altrettanto affascinanti per gli studenti di domani.
Questa storia mostra da una parte il ruolo della Scienza nella comprensione della natura e gli aspetti più positivi di questi studi e dall’altra l’enorme complessità degli organismi viventi. Non è solo un modo di dire, i pochi milioni di sostanze prodotte artificialmente in laboratorio sono poca cosa, se paragonati al numero impressionante e difficilmente quantificabile di biomolecole differenti approntate dagli organismi viventi.
Se alla fine della lettura di questo contributo sospettate di essere carenti di cobalamina sappiate che i sintomi della sua carenza possono impiegare dai 5 ai 6 anni per manifestarsi, dal momento in cui il rifornimento dell’organismo da fonti naturali è stato diminuito. Il 10% degli anziani ha una carenza di cobalamina che si manifesta con disturbi neuropsichiatrici. La carenza è generalmente dovuta ad un problema di assimilazione causato dalla mancanza del fattore intrinseco. Un difetto delle molecole che trasportano la cobalamina dal sangue ai tessuti può causare una carenza, anche quando nel siero è presente un buon livello di questa sostanza. I sintomi di una carenza iniziano con cambiamenti nel sistema nervoso, come ad esempio debolezza e dolore alle gambe e alle braccia, diminuzione dei riflessi e della percezione sensoriale, difficoltà nel camminare e nel parlare (balbuzie), spasmi muscolari, perdita della memoria, debolezza e stanchezza, disorientamento, perdita del tatto o minore percezione del dolore che si manifesta con diversi sintomi e intensità. Il consiglio possibile è solo uno, consultate un medico.
Nel frattempo possiamo suggerirvi un menù che, per l’apporto di cobalamina, è sicuramente indicato. Il fabbisogno giornaliero di cobalamina (alias vitamina B12) per l’uomo adulto e per i giovani è di 2 mcg, una quantità minima ma molto importante. Vi proponiamo allora un pranzo con le seguenti portate:
Fig. 12 – Risotto carote zenzero e vongole – (vongole cotte, 98.9 mg di cobalamina ogni 100 gr)
Fig. 13 – Fegato alla veneziana – (Fegato di vitello, 60 mg di cobalamina ogni 100 gr).
Fig. 14 – Torta Bavarese ai tre cioccolati – (Uova di gallina, 2 mg di cobalamina per uovo).
Per il vino vi consigliamo invece un bianco Verdicchio dei Castelli di Jesi da gustare con il risotto ed un rosso del veneto tipo Breganze Cabernet Sauvignon Doc con il fegato, non contengono cobalamina ma sono buoni. Caffè e ammazzacaffè sono graditi.
Dopo un pasto così non avrete ancora risposto alla domanda su come è nata la cobalamina ma sicuramente ne avrete fatta una scorta sufficiente da poter dormire tranquilli. Buon appetito.
Articolo pubblicato su: